Prinzipiell besitzen Nervenzellen, insbesondere beim jüngeren Patienten, ein ausgeprägtes Potential zur Regeneration [1]. Kommt es jedoch zu einer teilweisen oder vollständigen Kontinuitätsunterbrechung im Bereich der peripheren Ausläufer der Axone, beispielsweise durch einen Unfall oder Tumorleiden, kommt es zum teilweisen oder vollständigen Ausfall ihrer Funktion. Eine partielle oder komplette Fazialisparese liegt vor. Liegen die Nervenenden nah bei einander (oder wurden durch eine mikrochirurgische Nervennaht adaptiert), kann es zu einer vollständigen Heilung und einer kompletten Funktionsrückbildung kommen [2]. Kommt es zu einer Durchtrennung oder lokalen Beeinträchtigung (z.B. Druckschaden durch starke Schwellung des Nervens im Anteil seines knöchernen Verlaufes im Felsenbein im Rahmen der Bell-Parese mit nachfolgender Minderdurchblutung), läuft die Schädigung "quasi standardisiert" gemäß dem Prinzip der sogenannten "Waller-Degeneration" ab (siehe aus Pathophysiologie) [3]. Proximal der Läsion (Richtung Zellkörper im Gehirn) "lebt" der Nerv weiterhin, während der distale (gehirnferne) Teil abstirbt und somit mit den entsprechenden Ausfällen der betroffenen Muskulatur funktionslos wird.
Der distale Anteil bleibt jedoch als Struktur erhalten und kann als Leitschiene für vom lebendigen Nerventeil aussprossende Axone dienen, sofern diese ihn erreichen können. Dies ist möglich, wenn die Hüllstruktur (die Myelinscheide) noch intakt ist, oder der durchtrennte Nerv durch eine mikrochirurgische Nervennaht wieder adaptiert wird. Die Nervenfasern benötigen meist mindestens einen Monat Zeit, um eine Nervennaht überspringen zu können. Hierbei ist es wichtig, dass die Kontinuität wiederhergestellt ist, da ansonsten ein Einsprossen der Axone nicht möglich ist. Die erfolgreichen Axone nehmen den distalen, "toten" Anteil des Nervenverlaufes in ihrem Wachstum als Leitschiene, um erneut an ihrem Erfolgsorgan, dem Gesichtsmuskel anzukommen. Man rechnet auf dieser Strecke mit einem Verlust von 75-80% der Nervenfasern, d.h. nur etwa 20-25% der im gehirnnahen Nervenanteil vorhanden Axone erreichen tatsächlich das Zielorgan Muskel [4, 5]. Unter besten Voraussetzungen geht man hierbei von etwa 1mm Wachstumsstrecke pro Tag aus [6].
Rechenbeispiel: Liegt der Schädigungsort im Felsenbein, z.B. wie bei der Bell-Parese vermutet [3], etwa 10 cm vom Gesichtsmuskel im Mittelgesicht (z.B. Oberlippenheber) entfernt, so ist bei 1 mm Wachstum pro Tag theoretisch mit 100 Tagen (also etwa drei Monaten) zu rechnen bis der Muskel wieder angesteuert werden kann.
Kommt es also nach einer Zeit von einem halben Jahr (6 Monate) zu keinerlei Muskelaktivität oder Besserungszeichen, ist davon auszugehen, dass der Mechanismus der "Reinnervation", d.h. das Wiederansprechen des Muskels durch den neu aussprossenden Nerven nicht funktioniert hat und auch künftig unwahrscheinlich bleibt (siehe auch Prognose und Timing, time-is-muscle).
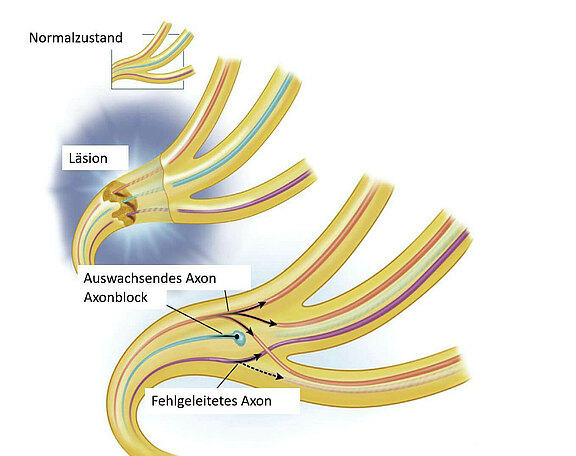
Manchmal kommt es beim Einwachsen zu unerwünschten Vertauschungen der heilenden Nervenfaserenden. Ähnlich wie bei einem Stromkabel, das aus mehreren einzelnen Leitungen besteht, wobei sich die Blaue mit der Grünen verbindet und das System somit nicht mehr richtig funktioniert. Es entsteht eine sogenannte Synkinesie (siehe hier auch Sykinesien): Bei Mimik kommt es zu ungewollten, störenden Mitbewegungen von nicht beabsichtigt angesteuerten Muskelgruppen. Wird im Rahmen einer Rekonstruktion der Kaumuskelnerv (N. massetericus) umgelagert, muss das Gehirn lernen, dass der Nerv, der ehemals einen Kaumuskel gesteuert hat, nun mimische Muskeln innerviert. Die Fähigkeit des "Umlernens" wird als neuronale Plastizität bezeichnet. Der Prozess involviert natürlich viel Training seitens des Patienten, aber das Gehirn besitzt diese Fähigkeit auch noch im Alter [7].
Durch Anpassung seiner Strukturen und Funktionen kann insbesondere das menschliche Nervensystem auf von außen herangetragene (extrinsische) und innerlich gründende (intrinsische) Reize (Stimuli) angepasst reagieren.[8] Diese Fähigkeit wird als neuronale Plastizität bezeichnet. Stimuli hierfür sind bspw. Nervenläsionen. Bereits innerhalb der ersten 48 Stunden nach der Läsion zeigt sich eine Aktivierung verschiedener neuronaler Netzwerke, die den initial entstandenen Schaden zu kompensieren versucht.[9] Im weiteren Verlauf kommt es u.a. durch sog. "synaptische Plastizität" zur Ausbildung neuer nervaler Verbindungen. "Synaptische Plastizität" gründet auf dem Prinzip der "Langzeitpotenzierung". Das bedeutet, dass durch Stimulation einer Nervenzelle (Neuron) ebendiese vermehrt Botenstoffe (Neurotransmitter) ausschüttet und in der Konsequenz leichter erregbar ist. Solchermaßen kommt es zu einer dauerhaften Minderung oder Verstärkung von Nervenverbindungen. Das wiederholte Beüben einer entsprechenden Bewegung kann die "synaptische Plastizität" positiv beeinflussen.[10] Ein weiteres Beispiel neuronaler Plastizität stellt die adulte Neurogenese dar, d.h. die Ausbildung neuer Nervenzellen auch im Erwachsenenalter. Es wird derzeit angenommen, dass hierbei der Riechkolben (Bulbus olfactorius) und der Hippocampus involviert sind.[11]
Ein weiteres Feld der neuronalen Plastizität ist die funktionale Umstrukturierung, die v.a. auf den Konzepten der Äquivalenz und der Vikarikation gründet. Das Prinzip der Äquivalenz erfasst den Ausgleich geschädigter Hirnareale durch die Gegenseite insbesondere in jüngeren Patienten.[12] Demgegenüber fällt unter Vikarikation die Übernahme ausgefallener Funktionen durch Hirnbereiche mit ursprünglich andersartigen Aufgaben. Hervorzuheben ist, dass beide Konzepte nur eine grundsätzliche Idee vermitteln, ohne neuronale Plastizität im Detail korrekt abzubilden. Des Weiteren summiert die sog. "Diaschisis" den Ansatz, dass eine Verletzung in einem bestimmten Hirnabschnitt auch zu einer Beeinträchtigung läsionsferner Bereiche führen kann.[13] Die klassische Variante bezeichnet nach Monakow bspw. die Minderdurchblutung eines Areals im Zuge eines Hirninfarkts, obwohl durch den Infarkt ein anderes Gebiet betroffen sein müsste. Davon ist die funktionale Diaschisis abzugrenzen, die den Ausfall eines Hirnareals erst bei Aktivierung eines anderen Gebiets feststellt. Darüber hinaus vollzieht sich neuronale Plastizität in Bereichen höherer Hirnfunktionen scheinbar langsamer.[14]
Bei Fazialisparesepatienten zeigt sich speziell bei Synkinesien eine insgesamt schwächere Aktivierung des Motorkortex, d.h. dem für die Willkürmotorik hauptsächlich verantwortlichen Bereich.[15] Außerdem werden motorische Areale im Gesunden bei Gesichtsbewegungen generell beidseits gleichermaßen beansprucht. Bei Patienten mit Fazialisparese ist demgegenüber eine einseitige Dominanz in der Inanspruchnahme dieser Abschnitte zu beobachten. Dies könnte auch in Zusammenhang mit einer Beeinträchtigung der neuronalen Plastizität stehen.
Abbildung 3
Neuronale Plastizität: die Ausbildung neuer nervaler Verbindungen kann durch intensives Training und Eigenübungen positiv beeinflusst werden. So können Prozesse zur Bewegung der Gesichtsmuskulatur neu ausgebildet oder neu geordnet werden. Im Englischen spricht man von "neuromuscular retraining".
Quellen:
[01] Yeo S-W, Lee D-H, Jun B-C, Chang K-H, Park Y-S. Analysis of prognostic factors in Bell's palsy and Ramsay Hunt syndrome. Auris Nasus Larynx 2007; 34(2):159–64.
[02] M F G, M M, S H, Khan WS. Peripheral nerve injury: principles for repair and regeneration. Open Orthop J 2014; 8:199–203.
[03] Glass GE, Tzafetta K. Bell's palsy: a summary of current evidence and referral algorithm. Fam Pract 2014; 31(6):631–42.
[04] Mackinnon SE, Dellon AL, Hunter DA. Histological assessment of the effects of the distal nerve in determining regeneration across a nerve graft. Microsurgery 1988; 9(1):46–51.
[05] Frey M, Happak W, Girsch W, Bittner RE, Gruber H. Histomorphometric studies in patients with facial palsy treated by functional muscle transplantation: new aspects for the surgical concept. Ann Plast Surg 1991; 26(4):370–9.
[06] Buchthal F, Kühl V. Nerve conduction, tactile sensibility, and the electromyogram after suture or compression of peripheral nerve: a longitudinal study in man. J Neurol Neurosurg Psychiatry 1979; 42(5):436–51.
[07] Buendia J, Loayza FR, Luis EO, Celorrio M, Pastor MA, Hontanilla B. Functional and anatomical basis for brain plasticity in facial palsy rehabilitation using the masseteric nerve. J Plast Reconstr Aesthet Surg 2016; 69(3):417–26.
[08] Mateos-Aparicio P, Rodríguez-Moreno A. The Impact of Studying Brain Plasticity. Front Cell Neurosci. 2019 Feb 27;13:66. doi: 10.3389/fncel.2019.00066.
[09] Sophie Su Y, Veeravagu A, Grant G. Neuroplasticity after Traumatic Brain Injury. In: Laskowitz D, Grant G, edi-tors. Translational Research in Traumatic Brain Injury. Boca Raton (FL): CRC Press/Taylor and Francis Group; 2016. Chapter 8. PMID: 26583189.
[10] Hötting K, Röder B. Beneficial effects of physical exercise on neuroplasticity and cognition. Neurosci Biobehav Rev. 2013 Nov;37(9 Pt B):2243-57. doi: 10.1016/j.neubiorev.2013.04.005. Epub 2013 Apr 25. PMID: 23623982.
[11] La Rosa C, Parolisi R, Bonfanti L. Brain Structural Plasticity: From Adult Neurogenesis to Immature Neurons. Front Neurosci. 2020 Feb 4;14:75. doi: 10.3389/fnins.2020.00075. PMID: 32116519; PMCID: PMC7010851.
[12] Finger S. Chapter 51: recovery of function: redundancy and vicariation theories. Handb Clin Neurol. 2010;95:833-41. doi: 10.1016/S0072-9752(08)02151-9. PMID: 19892154.
[13] Finger S. Chapter 51: recovery of function: redundancy and vicariation theories. Handb Clin Neurol. 2010;95:833-41. doi: 10.1016/S0072-9752(08)02151-9. PMID: 19892154.
[14] Klingner CM, Volk GF, Brodoehl S, Burmeister HP, Witte OW, Guntinas-Lichius O. Time course of cortical plastic-ity after facial nerve palsy: a single-case study. Neurorehabil Neural Repair. 2012 Feb;26(2):197-203. doi: 10.1177/1545968311418674. Epub 2011 Aug 29. PMID: 21875890.
[15] Wang Y, Wang WW, Hua XY, Liu HQ, Ding W. Patterns of cortical reorganization in facial synkinesis: a task func-tional magnetic resonance imaging study. Neural Regen Res. 2018 Sep;13(9):1637-1642. doi: 10.4103/1673-5374.235304. PMID: 30127126; PMCID: PMC6126138.