Die Epidemiologie (von griech. "epidēmíā nósos" "über das ganze Volk verbreitete Krankheit", lógos "Lehre") beschäftigt sich mit der Verbreitung sowie den Ursachen und Folgen von Krankheiten in der Bevölkerung. Die Ätiologie hingegen mit den Ursachen für das Entstehen einer Erkrankung.
Die Prävalenz (Häufigkeit einer Krankheit oder eines Symptoms in einer Bevölkerung zu einem bestimmten Zeitpunkt) von Lähmungen des N. facialis wurde in multiplen Studien untersucht und schwankt zwischen 17 und 35 Fälle auf 100000 Einwohner für alle Formen der Parese [1–5]. Untersuchungen aus Großbritannien und Kanada zeigten eine Inzidenz (Häufigkeit von Neuerkrankungen in einem bestimmten Zeitraum) von 13,1 bis 20,2/ 100000 [6,7] für eine idiopathische (ohne bekannte Ursache) Gesichtslähmung (Bell-Parese). Eine Studie aus dem Jahr 1975 beschrieb die Inzidenz einer Bell´schen Parese in der Schwangerschaft mit 45/ 100000 im Vergleich zu 17/ 100000 bei Nicht-Schwangeren. Bislang konnte keine signifikante Prädilektion bzgl. Herkunft, Geschlecht oder Ethnizität festgestellt werden [1,19]. Diverse Studien [1,2,8-10] konnten zeigen, dass das Risiko, an einer Fazialisparese nach Bell zu erkranken, im Alter zwischen 15 und 45 Jahren am höchsten ist.
Die Bell-Parese, benannt nach dem schottischen Chirurgen Sir Charles Bell (1774–1842), ist die häufigste idiopathische Fazialisparese. Frauen und Männer sind gleich häufig betroffen, obwohl das Risiko während der Schwangerschaft möglicherweise erhöht ist. Der genaue Schädigungsmechanismus ist nicht hinreichend erforscht. Es wird angenommen, dass eine Entzündung (wahrscheinlich viral) zum Anschwellen des Nervens im Bereich des Schädelknochendurchtritts (Canalis n. facialis) führt. Die Nervenfasern werden hierbei durch die Kompression und die resultierende Minderdurchblutung geschädigt (siehe Pathophysiologie) (11). Als Auslöser der Entzündung werden autoimmune (körpereigene) Reaktionen oder die Reaktivierung einer Herpes-simplex-Virus-Infektion (HSV Typ 1) vermutet. Verbleibende Symptome können muskuläre Schwäche, Synkinesien (Massenbewegungen), Tränenlaufen und Kontrakturen sein.
Elektronenmikroskopisches Bild eines Herpes-Simplex-Virus, Typ I. Ein Befall des Fazialisnerven kann über eine Entzündung des Nervens (Neuritis) eine Anschwellung bewirken. Im engen Canalis Facialis („Felsenbeinkanal“) wiederum bestehen für den Fazialisnerven sehr begrenzte Raumverhältnisse. Es kommt hierdurch zu Schädigungen des Nerven.
Quelle: Dr. Erskine Palmer, CDC, Transmission electron micrograph of herpes simplex virus. Some nucleocapsids are empty, as shown by penetration of electron-dense stain, Atlanta, GA 30329-4027 USA, 1981, phil.cdc.gov/PHIL_Images/08301998/00014/B82-0474_lores.jpg, accessed on 08/28/2020.
Bei einer akuten (frisch aufgetretenen) Bell-Parese ist eine Therapie mit Glukokortikoiden zu empfehlen. Mögliche Schemata sind: zehn Tage 2x25 mg Prednisolon[12] oder fünf Tage 60 mg Prednisolon[13]. Eine Kombination mit Virustatika ist, außer bei sehr schweren Formen, nicht zu empfehlen [14]. Die Akutbehandlung sollte zeitnah zum Auftreten der Parese immer durch einen Facharzt für Neurologie bzw. Hals-Nasen-Ohren-Heilkunde erfolgen und wird häufig im Rahmen eines kurzen stationären Aufenthaltes in der Klinik durchgeführt. Im Rahmen dessen werden andere Ursachen, wie z.B. eine Borrelliose, durch Laboruntersuchungen und ggf. einer Lumbalpunktion ausgeschlossen.
In den letzten Jahren wurden zwei große Studien publiziert, die sich mit der Ätiologie von Fazialisparesen beschäftigt haben:
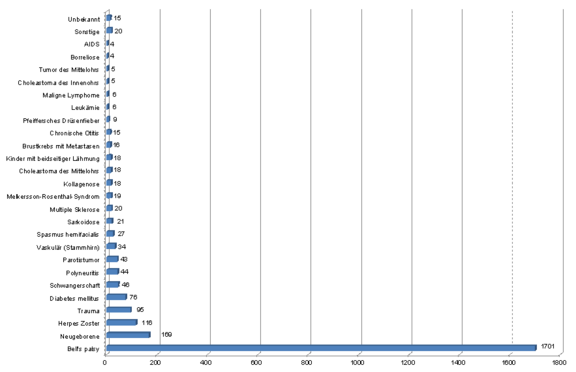
Für seine Veröffentlichung aus dem Jahr 2002 untersuchte Erik Peitersen [1] insgesamt 2570 Fälle von peripheren Fazialisparesen über einen Zeitraum von 25 Jahren.
Marc Hohman et al. [11] verwendeten für ihre Publikation aus dem Jahr 2014 einen Datensatz von 1989 Patienten über zehn Jahre.
Diese Studien müssen natürlich unter dem kritischen Aspekt betrachtet werden, dass der verwendete Datensatz nicht zwingend einen repräsentativen Ausschnitt aus der Gesamtbevölkerung wiederspiegelt. Der Patientenstamm, der diesen klinischen Untersuchungen zugrunde liegt, wird maßgeblich durch die Lage und Spezialisierungsrichtung der jeweiligen Kliniken und Zentren beeinflusst.
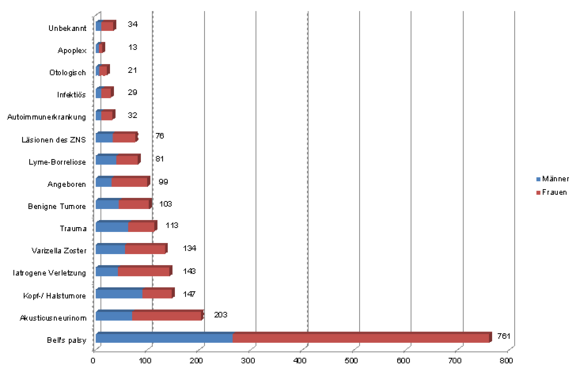
Nichtsdestotrotz zeigen die Studien von Peitersen und Hohman et al., dass die idiopathische (ohne bekannte Ursache bzw. kein wissenschaftlich belegter Pathomechanismus bekannt) Fazialislähmung nach Bell den größten Anteil an Fazialisparesen darstellt (Peitersen: 66,19% und Hohman: 38,26%). Des Weiteren spielen kongenitale (angeborene) Paresen, Traumata, Infektionen sowie Tumorerkrankungen eine bedeutende Rolle.
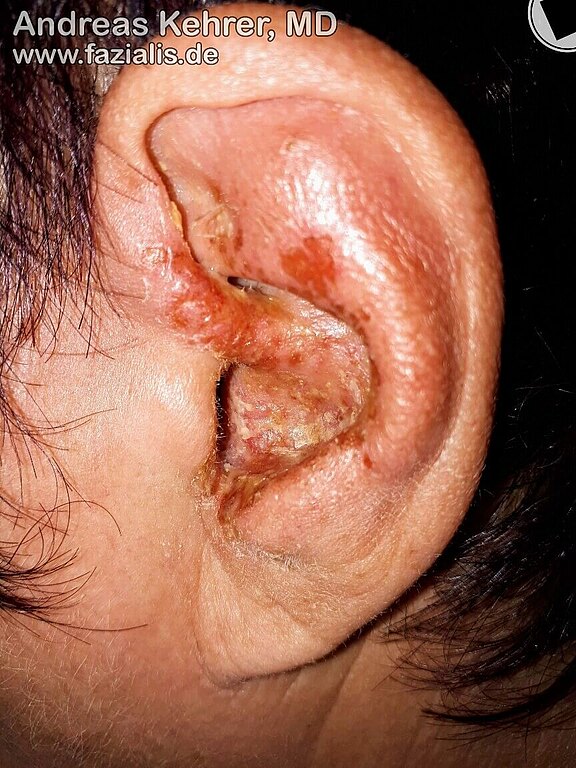
Nicht selten führen Infektionen des Herpes Zoster-Virus (Gürtelrose) im Kopf-/Hals-Bereich zu einer Fazialisparese. Hier im Bild sind die Bläschen der Virusinfektion (schmerzhafter, erythematös-vesikulärer Hautausschlag) rund um und im Gehörgang (Herpes zoster oticus) gut zu erkennen. Es handelt sich um eine direkte Infektion von Hirnnerven. Ist der N. Fazialis ebenfalls betroffen kann es zum Funktionsausfall mit Gesichtslähmung auf der derselben Seite kommen. Im angloamerikanischen Sprachraum wird der Symptomenkomplex auch als Ramsay-Hunt-Syndrom[15] bezeichnet , benannt nach dem amerikanischen Neurologen James Ramsay Hunt (1874–1937). Die auch auch als Ramsay-Hunt-Neuralgie bekannte Erkrankung ist ebenfalls durch andere Hirnnervenläsionen gekennzeichnet. Als auftretende Komplikation kommen z.B. Nervenschmerzen (Neuralgien) vor. Weitere häufige Manifestationen sind Hörverlust, Tinnitus (Ohrensausen), Schwindel, Übelkeit, Erbrechen und Nystagmus (unkontrollierbare, rhythmische Augenbewegungen).
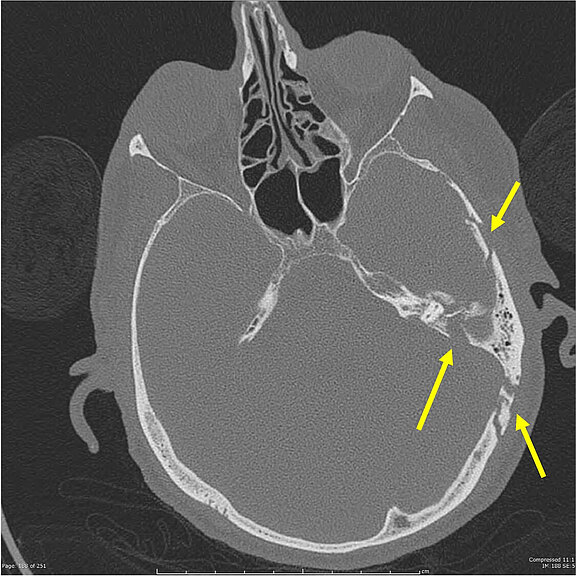
Computertomographie (CT) des Schädels. Es ist ein Schädelbasisbruch mit einer Fraktur des Felsenbeins (gelbe Pfeile) zu sehen. Da der Fazialisnerv durch den Felsenbeinkanal (Canalis nervi facialis) verläuft, kommt es bei derartigen Frakturen sehr häufig zur Schädigungen des Nervens.
Quelle: Dr. Steve Lau, Radiopedia, Complex, comminuted temporal bone fracture, n.d., radiopaedia.org/cases/complex-comminuted-temporal-bone-fracture, accessed on 08/28/2020.
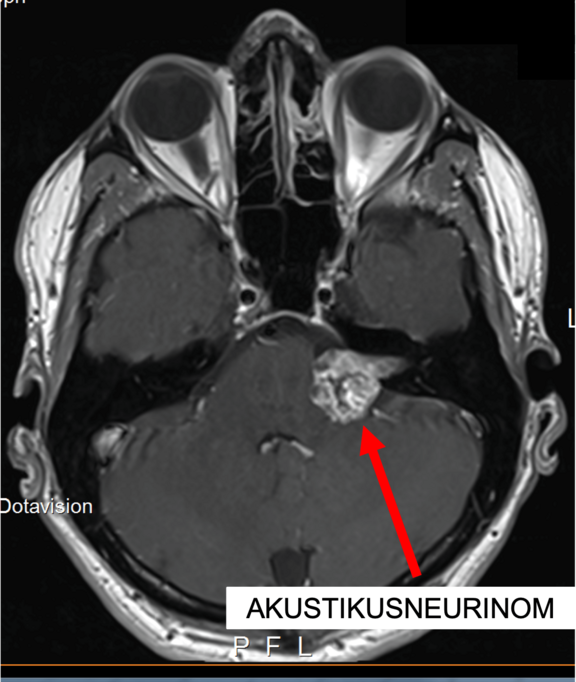
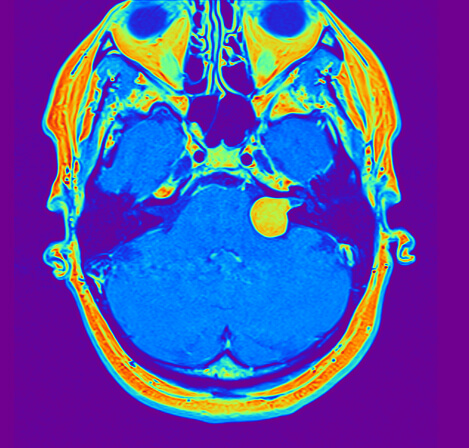
In dieser Magnetresonanztomographie (MRT)- Schnittbilddiagnostik ist ein Akustikusneurinom an der linken Schädelbasis als Ursache einer Gesichtslähmung gut zu erkennen: die Signalanhebung zeigt einen (hier hell dargestellten) verdrängend wachsenden Tumor mit einem Ausläufer in das (hier dunkel/schwarz dargestellte) Felsenbein, durch welches auch der Fazialisnerv durch einen knöchernen Kanal zieht. Die Folge des Tumorwachstums ist eine Kompression des Fazialisnervens mit der entsprechenden Symptomatik einer vollständigen oder teilweisen Gesichtslähmung, je nachdem wieviele Nervenfasern beeinträchtigt werden.
Quelle: Patrick J. Lynch, Dr. C. Carl Jaffe, Sagittal cuts of the encephalic trunk. Number 7: the facial nerve nucleus, Number 6: abducens nucleus, 12/23/2006, de.wikipedia.org/wiki/Datei:Brain_stem_sagittal_section.svg, accessed on 08/28/2020, CC BY-SA 2.5. creativecommons.org/licenses/by-sa/2.5.
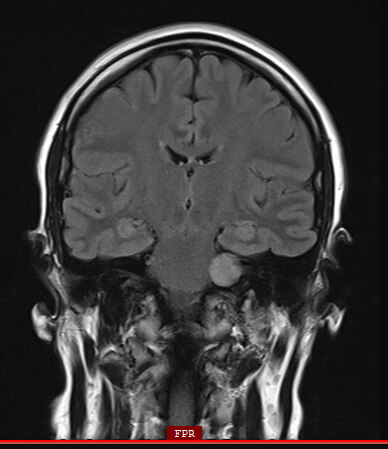
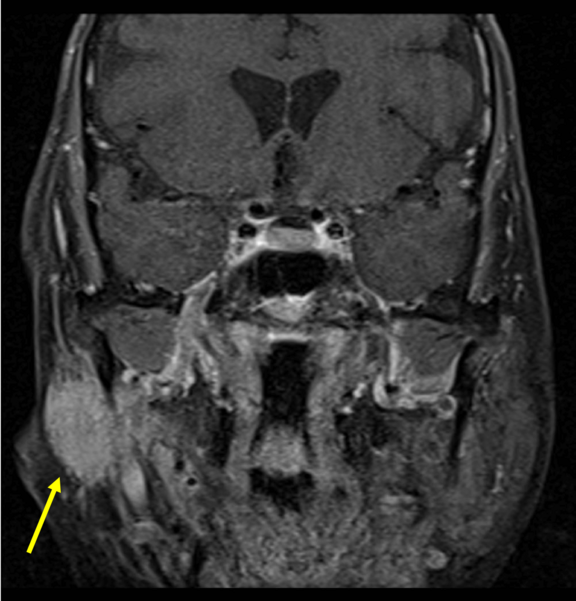
Ebenso können Prozesse ausserhalb des Schädels, jedoch innerhalb der Ohrspeicheldrüse (Glandula parotis) Funktionsstörungen des Fazialisnervenastsystems verursachen. Auf dieser MRT-Aufnahme ist ein adenozystische Karzinom (gelber Pfeil) zu sehen. Sehr viel häufiger sind jedoch gutartige Tumore der Ohrspeicheldrüse. Die Verteilung der Ohrspeicheldrüsengeschwulste liegt bei etwa 80% gutartigen und 20% bösartigen Befunden. Der überragend häufigste gutartige Speicheldrüsentumor stellt das pleomorphe Adenom dar. Am zweithäufigsten kommt der ebenfalls gutartige Warthin-Tumor (Zystadenolymphom) vor. Entfernungen der Ohrspeicheldrüse (Parotidektomien) rufen laut internationaler Literatur nur in 2-6% aller Fälle permanente Gesichtslähmungen hervor [16]. Vorübergehende Nervenlähmungen hingegen werden in 25-60% der Fälle beobachtet [17].
Quelle: Published as “Jto410”, Coronal fat-suppressed post gadolinium enhanced T1-weighted image showing and enhancing right parotid mass with perineural spread of tumor along the trigeminal nerve. In my clinical work as radiologist, 09/09/2013, commons.wikimedia.org/wiki/File:Coronal_MRI_showing_right_parotid_adenoid_cystic_carcinoma_with_perineural_spread_of_tumor.jpg, accessed on 08/28/2020, CC BY-SA 3.0. creativecommons.org/licenses/by-sa/3.0.
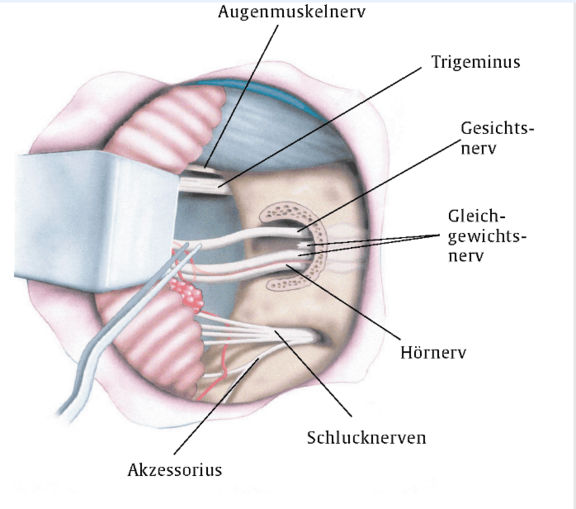
Wie auch andere Tumoren der Schädelbasis wächst das Akustikusneurinom in unmittelbarer Nähe von verschiedenen Hirnnerven, die hier aufgezeigt sind. Handelt es sich um einen größeren Tumor, so kann dieser die Hirnnerven umscheiden bzw. ummauern. Entweder direkt durch das Tumorwachstum oder bei Tumorentfernung können hierdurch vorübergehende oder permanente Funktionseinschränkungen der Hirnnerven, auch des Fazialisnerven, resultieren. Müssen die Nerven aufgrund der Tumorgröße bei der Tumorentfernung mit entfernt werden, resultiert eine Nervenlücke mit Komplettausfall des betreffenden Nerven ohne Aussicht einer Primärheilung des Nerven. Man spricht von „fehlender Kontinuität“, die beim Fazialisnerven in einer vollständigen, schlaffen Gesichtslähmung resultiert. In diesen Fällen sollte eine Nervenrekonstruktion frühzeitig geplant werden.
Quelle: Thieme Compliance_ChN8_Schädel_Gehirn-Operation_1/2019
Das Möbius Syndrom stellt sich charakteristischerweise als angeborene (kongenitale) Lähmung insbesondere des VI. und des VII. Hirnnervs dar.[18] Benannt ist das Möbius Syndrom nach dem deut-schen Neurologen Paul Julius Möbius (1853-1907). Dabei lassen sich sowohl ein- als auch beidseitige Nervenausfälle beobachten. Grundsätzlich schreitet die Erkrankung nicht voran. Die Inzidenz liegt bei circa 0,002%, d. h. nur 1 unter 50000 Neugeborenen ist betroffen.[19] Die Prävalenz wird auf etwa 1 zu 500000 geschätzt.[20]
Das Geschlechterverhältnis wird zwischen 4:1, mit mehrheitlich betroffenen Frauen, und 1:3 ange-geben.[21,22] Ein Zusammenhang u. a. mit Kokainmissbrauch und der Therapie mit dem Betablocker Misoprostol während der Schwangerschaft kann bestehen.[23,24] Die Diagnose des Möbius Syndroms stützt sich auf die klinische Beurteilung und orientiert sich am sog. "CLUFT Grading System".[25] Dem-gemäß werden Anomalien der Hirnnerven, der oberen wie unteren Extremität, der Gesichtsstruk-turen und des Brustkorbs (Thorax) erfasst und jeweils der entsprechende Schweregrad bestimmt. Abgesehen von klinischen Kriterien manifestiert sich das Möbius Syndrom auch auf genetischer Ebene, wie z. B. durch de novo Mutationen.[26] Derartige Mutationen sind in vorangegangenen Ge-nerationen klassischerweise nicht nachzuweisen.
Ferner fallen das Möbius Syndrom und Erkrankungen aus dem autistischen Formenkreis weniger stark gehäuft zusammen als ursprünglich angenommen.[27] Probleme in der sozialen Interaktion scheinen mit zunehmendem Alter stärker ausgeprägt.
Hervorzuheben bleibt, dass auch in diesen Fällen eine plastisch-funktionelle Rekonstruktion grundsätzlich möglich ist. So wurde interessanterweise die freie gracilis-Muskeltransplantation mit Anschluss an den Kaumuskelnerv (N. massetericus) zunächst bei Patienten mit Möbius Syndrom durchgeführt.[28] Die Resultate waren derart über-zeugend, dass der N. massetericus als Spendernerv (donor nerve) auch für weitere Patientengruppen mit Fazialisparese zunehmend an Relevanz gewann. Darüber hinaus kann je nach Ausprä-gungsgrad zwischen verschiedenen Therapieoptionen gewählt werden. Bei beidseitiger Nichtanlage (Agenesie) der für das Lächeln verantwortlichen Muskulatur ist der Transfer eines Oberschenkelmuskels (M. gracilis) in beide Gesichtshälften mit mikro-chirurgischem Anschluss bspw. an den Kaumuskelnerv Mittel der Wahl. Dieses Therapieverfahren ermöglicht ein symmetrischeres und ausgeprägteres Lächeln.[29]
Quellen:
[1] Peitersen E. Bell's palsy: the spontaneous course of 2,500 peripheral facial nerve palsies of different etiologies. Acta Otolaryngol Suppl. 2002(549):4–30. PubMed PMID: 12482166.
[2] Devriese PP, Schumacher T, Scheide A, Jongh RH de, Houtkooper JM. Incidence, prognosis and recovery of Bell's palsy. A survey of about 1000 patients (1974-1983). Clin Otolaryngol Allied Sci. 1990;15(1):15–27. PubMed PMID: 2323075.
[3] Furuta Y, Ohtani F, Sawa H, Fukuda S, Inuyama Y. Quantitation of varicella-zoster virus DNA in patients with Ramsay Hunt syndrome and zoster sine herpete. J Clin Microbiol. 2001;39(8):2856–9. doi: 10.1128/JCM.39.8.2856-2859.2001. PubMed PMID: 11474003.
[4] Hauser WA, Karnes WE, Annis J, Kurland LT. Incidence and prognosis of Bell's palsy in the population of Rochester, Minnesota. Mayo Clin Proc. 1971;46(4):258–64. PubMed PMID: 5573820.
[5] Katusic SK, Beard CM, Wiederholt WC, Bergstralh EJ, Kurland LT. Incidence, clinical features, and prognosis in Bell's palsy, Rochester, Minnesota, 1968-1982. Ann Neurol. 1986;20(5):622–7. doi: 10.1002/ana.410200511. PubMed PMID: 3789675.
[6] Morris AM, Deeks SL, Hill MD, Midroni G, Goldstein WC, Mazzulli T, et al. Annualized incidence and spectrum of illness from an outbreak investigation of Bell's palsy. Neuroepidemiology. 2002;21(5):255–61. PubMed PMID: 12207155.
[7] Rowlands S, Hooper R, Hughes R, Burney P. The epidemiology and treatment of Bell's palsy in the UK. Eur J Neurol. 2002;9(1):63–7. PubMed PMID: 11784378.
[8] May M, Hardin WB, Sullivan J, Wette R. Natural history of bell's palsy: the salivary flow test and other prognostic indicators. Laryngoscope. 1976;86(5):704–12. doi: 10.1288/00005537-197605000-00011. PubMed PMID: 778512.
[9] Park HW, Watkins AL. Facial paralysis; analysis of 500 cases. Arch Phys Med Rehabil. 1949;30(12):749–62. PubMed PMID: 15399425.
[10] Prescott CA. Idiopathic facial nerve palsy (the effect of treatment with steroids). J Laryngol Otol. 1988;102(5):403–7. PubMed PMID: 3397632.
[11] Graeme E Glass, Bell’s palsy: a summary of current evidence and referral algorithm, Family Practice, 2014, Vol. 31, No. 6, 631–642
[12] Sullivan FM, Swan IR, Donnan PT, Morrison JM, Smith BH, McKinstry B, Davenport RJ, Vale LD, Clarkson JE, Hammersley V, Hayavi S, McAteer A, Stewart K, Daly F. Early treatment with prednisolone or acyclovir in Bell's palsy. N Engl J Med 2007;357:1598-1607.
[13] Engström M, Berg T, Stjernquist-Desatnik A, Axelsson S, Pitkäranta A, Hultcrantz M, Kanerva M, Hanner P, Jonsson L. Prednisolone and valaciclovir in Bell's palsy: a randomised, double-blind, placebo-controlled, multicentre trial. Lancet Neurol 2008;7:993-1000.
[14] Gagyor I, Madhok VB, Daly F, Somasundara D, Sullivan M, Gammie F, Sullivan F. Antiviral treatment for Bell ́s palsy (idiopathic facial paralysis). Cochrane Database of Systematic Reviews 2015;5:CD001869.
[15] C. Sweeney, D. Gilden: Ramsay Hunt syndrome. In: Journal of Neurology, Neurosurgery, and Psychiatry (J Neurol Neurosurg Psychiatry.) August 2001, Band 71, Nummer 2, S. 149–154, doi:10.1136/jnnp.71.2.149.
[16] Koch M, Zenk J, Iro H. Long-term results of morbidity after parotid gland surgery in benign disease. Laryngoscope. 2010;120(4):724–30
[17] Eviston TJ, Yabe TE, Gupta R, Ebrahimi A, Clark JR. Parotidectomy: surgery in evolution. ANZ J Surg. 2016;86(3):193–9
[18] Picciolini O, Porro M, Cattaneo E, Castelletti S, Masera G, Mosca F, Bedeschi MF. Moebius syndrome: clinical features, diagnosis, management and early intervention. Ital J Pediatr. 2016 Jun 3;42(1):56. doi: 10.1186/s13052-016-0256-5. PMID: 27260152; PMCID: PMC4893276.
[19] Verzijl HT, van der Zwaag B, Cruysberg JR, Padberg GW. Möbius syndrome redefined: a syndrome of rhomben-cephalic maldevelopment. Neurology. 2003 Aug 12;61(3):327-33. doi: 10.1212/01.wnl.0000076484.91275.cd. PMID: 12913192.
[20] Herrera C, Mendieta P, Muzzio L. Reporte de caso clínico: síndrome de moebius. Rev Med FCM‐UCSG. 2010;16(3):237‐242.
[21] Strömland K, Sjögreen L, Miller M, Gillberg C, Wentz E, Johansson M, Nylén O, Danielsson A, Jacobsson C, An-dersson J, Fernell E. Mobius sequence--a Swedish multidiscipline study. Eur J Paediatr Neurol. 2002;6(1):35-45. doi: 10.1053/ejpn.2001.0540. PMID: 11993954.
[22] Pedersen LK, Maimburg RD, Hertz JM, Gjørup H, Pedersen TK, Møller-Madsen B, Østergaard JR. Moebius se-quence -a multidisciplinary clinical approach. Orphanet J Rare Dis. 2017 Jan 6;12(1):4. doi: 10.1186/s13023-016-0559-z. PMID: 28061881; PMCID: PMC5217236.
[23] Puvabanditsin S, Garrow E, Augustin G, Titapiwatanakul R, Kuniyoshi KM. Poland-Möbius syndrome and cocaine abuse: a relook at vascular etiology. Pediatr Neurol. 2005 Apr;32(4):285-7. doi: 10.1016/j.pediatrneurol.2004.11.011. PMID: 15797189.
[24] Ventura BV, Miller MT, Danda D, Carta A, Brandt CT, Ventura LO. Profile of ocular and systemic characteristics in Möbius sequence patients from Brazil and Italy. Arq. Bras. Oftalmol. 2012 June; 75( 3 ): 202-6. doi: 10.1590/S0004-27492012000300011.
[25] Abramson DL, Cohen MM Jr, Mulliken JB. Möbius syndrome: classification and grading system. Plast Reconstr Surg. 1998 Sep;102(4):961-7. doi: 10.1097/00006534-199809040-00004. PMID: 9734409.
[26] Tomas-Roca L, Tsaalbi-Shtylik A, Jansen JG, Singh MK, Epstein JA, Altunoglu U, Verzijl H, Soria L, van Beusekom E, Roscioli T, Iqbal Z, Gilissen C, Hoischen A, de Brouwer APM, Erasmus C, Schubert D, Brunner H, Pérez Aytés A, Marin F, Aroca P, Kayserili H, Carta A, de Wind N, Padberg GW, van Bokhoven H. De novo mutations in PLXND1 and REV3L cause Möbius syndrome. Nat Commun. 2015 Jun 12;6:7199. doi: 10.1038/ncomms8199. PMID: 26068067; PMCID: PMC4648025.
[27] Briegel W, Schimek M, Kamp-Becker I. Moebius sequence and autism spectrum disorders--less frequently associated than formerly thought. Res Dev Disabil. 2010 Nov-Dec;31(6):1462-6. doi: 10.1016/j.ridd.2010.06.012. PMID: 20621443.
[28] Morales-Chávez M, Ortiz-Rincones MA, Suárez-Gorrin F. Surgical techniques for smile restoration in patients with Möbius syndrome. J Clin Exp Dent. 2013 Oct 1;5(4):e203-7. doi: 10.4317/jced.51116. PMID: 24455082; PMCID: PMC3892243.
[29] Roy M, Klar E, Ho ES, Zuker RM, Borschel GH. Segmental Gracilis Muscle Transplantation for Midfacial Ani-mation in Möbius Syndrome: A 29-Year Experience. Plast Reconstr Surg. 2019 Mar;143(3):581e-591e. doi: 10.1097/PRS.0000000000005368. PMID: 30817662.